Das Prinzip von Le Chatelier
19/12/16 18:05
1. Herstellung von "Bier"


2. Das Prinzip von Le Chatelier: chemische Gleichgewichte qualitativ betrachtet
a) Einfluss der Temperatur auf die Lage des Gleichgewichts
Beispiel 1: NO2-N2O4-Gleichgewicht (exotherme Reaktion)
links aufgeheizt; rechts Raumtemperatur

Abkühlen

Beispiel 2: Iod-Stärke-Gleichgewicht (exotherme Reaktion)

Aufheizen:

Abkühlen

b) Einfluss der Konzentration auf die Lage des Gleichgewichts
Beispiel: Fe(III)-SCN-Gleichgewicht


von links nach rechts: 1. Vergleichslösung (rote Farbe von Fe(SCN)3; 2. Zugabe von Fe(III); 3. Zugabe von (SCN-); 4. Zugabe von OH- (-> Ausfallen von Fe(OH)3)
c) Zusammenfassung der Experimente:

d) Einfluss des Katalysators auf die Lage des Gleichgewichts: nur auf die Schnelligkeit, mit der sich das Gleichgewicht einstellt!
Protokoll (Jano): ProtokollJano


2. Das Prinzip von Le Chatelier: chemische Gleichgewichte qualitativ betrachtet
a) Einfluss der Temperatur auf die Lage des Gleichgewichts
Beispiel 1: NO2-N2O4-Gleichgewicht (exotherme Reaktion)
links aufgeheizt; rechts Raumtemperatur

Abkühlen

Beispiel 2: Iod-Stärke-Gleichgewicht (exotherme Reaktion)

Aufheizen:

Abkühlen

b) Einfluss der Konzentration auf die Lage des Gleichgewichts
Beispiel: Fe(III)-SCN-Gleichgewicht


von links nach rechts: 1. Vergleichslösung (rote Farbe von Fe(SCN)3; 2. Zugabe von Fe(III); 3. Zugabe von (SCN-); 4. Zugabe von OH- (-> Ausfallen von Fe(OH)3)
c) Zusammenfassung der Experimente:

d) Einfluss des Katalysators auf die Lage des Gleichgewichts: nur auf die Schnelligkeit, mit der sich das Gleichgewicht einstellt!
Protokoll (Jano): ProtokollJano
chemisches Gleichgewicht: Modellversuch
12/12/16 16:08
Modellversuch zum chemischen Gleichgewicht
a) Modellversuch
Aufbau und Durchführung:
Anfangszustand I: links: Stoff A (100 mL), dickes Röhrchen; rechts: Stoff B (0 mL), dünnes Röhrchen

Anfangszustand II: links: Stoff A (0 mL), dickes Röhrchen; rechts: Stoff B (100 mL), dünnes Röhrchen

Anfangszustand III: links: Stoff A (50 mL), dickes Röhrchen; rechts: Stoff B (50 mL), dünnes Röhrchen

Endzustand – unabhängig vom Anfangszustand -> Gleichgewicht: links: Stoff A (30 mL), dickes Röhrchen; rechts: Stoff B (70 mL), dünnes Röhrchen

b) Auswertung:
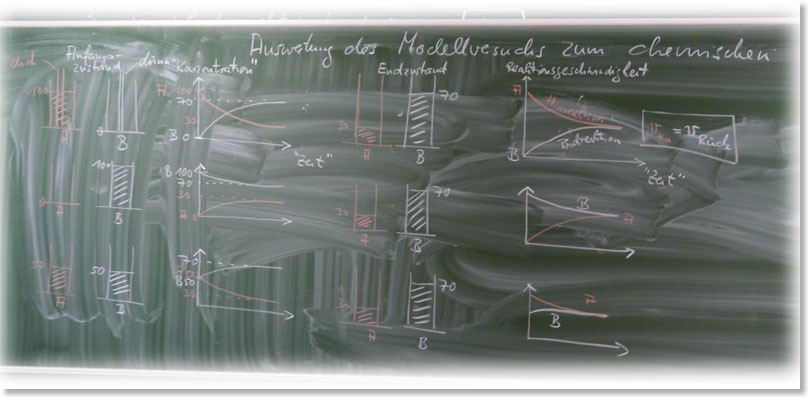
c) Kennzeichen des chemischen Gleichgewichts

Protokoll (Luca): ProtokollLuca
a) Modellversuch
Aufbau und Durchführung:
Anfangszustand I: links: Stoff A (100 mL), dickes Röhrchen; rechts: Stoff B (0 mL), dünnes Röhrchen

Anfangszustand II: links: Stoff A (0 mL), dickes Röhrchen; rechts: Stoff B (100 mL), dünnes Röhrchen

Anfangszustand III: links: Stoff A (50 mL), dickes Röhrchen; rechts: Stoff B (50 mL), dünnes Röhrchen

Endzustand – unabhängig vom Anfangszustand -> Gleichgewicht: links: Stoff A (30 mL), dickes Röhrchen; rechts: Stoff B (70 mL), dünnes Röhrchen

b) Auswertung:

c) Kennzeichen des chemischen Gleichgewichts

Protokoll (Luca): ProtokollLuca
Lebensmittel-Vorträge (Ende)
09/12/16 12:04
1. Lebensmittelchemie VI: Süßstoffe – chemisch betrachtet (Lotta)
2. Lebensmittelchemie VII: Proteinshakes – chemisch betrachtet (Paul R.)
Notenbesprechung
2. Lebensmittelchemie VII: Proteinshakes – chemisch betrachtet (Paul R.)
Notenbesprechung
Reaktionsbedingungen: Konzentration und Temperatur
05/12/16 18:18
1. Lebensmittelchemie V: Brötchen – chemisch betrachtet (Leonie)
2. Besprechung der Hausaufgabe: Durchschnittsgeschwindigkeit und Momentangeschwindigkeit
3. Versuche Reaktionsbedingungen
a) Konzentrationsabhängigkeit
b) Temperaturabhängigkeit
am Beispiel: Natriumthiosulfat/Salzsäure



Protokoll (Paul G.): ProtokollPaulG
2. Besprechung der Hausaufgabe: Durchschnittsgeschwindigkeit und Momentangeschwindigkeit
3. Versuche Reaktionsbedingungen
a) Konzentrationsabhängigkeit
b) Temperaturabhängigkeit
am Beispiel: Natriumthiosulfat/Salzsäure



Protokoll (Paul G.): ProtokollPaulG
Reaktionsgeschwindigkeit
02/12/16 18:10
1. Lebensmittelchemie IV: Joghurt – chemisch betrachtet (Jano) Joghurt
2. Besprechung der Klausur
3. Versuch Reaktionsgeschwindigkeit

Zink reagiert mit Salzsäure (1 mol/l). (Zink liegt im Überschuss vor: Die H+-Konzentration verringert sich durch die Reaktion.)
4. Zeit-Konzentrations-Diagramm: Durchschnitts- und Momentangeschwindigkeit
Definition der Reaktionsgeschwindigkeit v
siehe Hausaufgabe: Arbeitsblatt Reaktionsverlauf für die Reaktion von Zink mit Salzsäure
2. Besprechung der Klausur
3. Versuch Reaktionsgeschwindigkeit

Zink reagiert mit Salzsäure (1 mol/l). (Zink liegt im Überschuss vor: Die H+-Konzentration verringert sich durch die Reaktion.)
4. Zeit-Konzentrations-Diagramm: Durchschnitts- und Momentangeschwindigkeit
Definition der Reaktionsgeschwindigkeit v
siehe Hausaufgabe: Arbeitsblatt Reaktionsverlauf für die Reaktion von Zink mit Salzsäure

